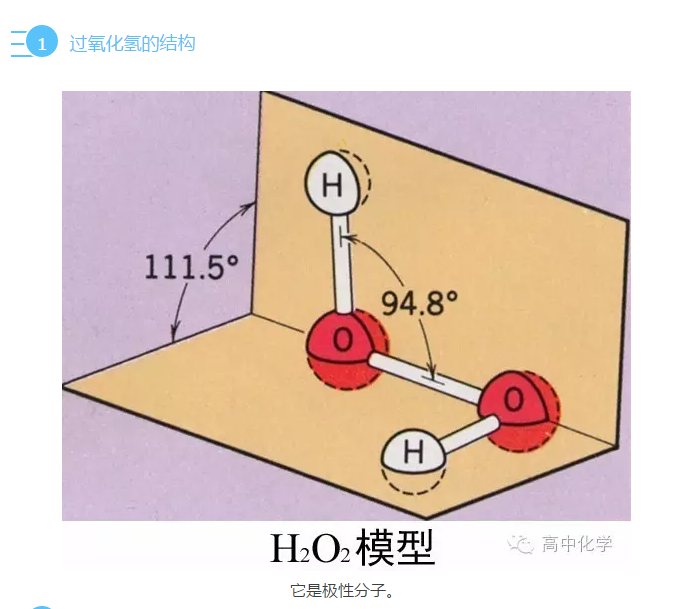
水在实验中的妙用
1. 水封
在中学化学实验中,液溴需要水封,少量白磷放入盛有冷水的广口瓶中保存,通过水的覆盖,既可隔绝空气预防白磷蒸气逸出,又可使其维持在燃点之下;
液溴极易,挥发有剧毒,它在水中溶解度较小,比水重,所以亦可进行水封降低其挥发。
2. 水浴
酚醛树脂的制备(沸水浴);
硝基苯的制备(5060℃)、
乙酸乙酯的水解(70~80℃)、
蔗糖的水解(70~80℃)、
硝酸钾溶解度的测定(室温~100℃)需用温度计来控制温度;
银镜反应需用温水浴加热即可。
3. 水集
排水集气法可以采集难溶或不溶于水的气体,中学阶段有O2, H2,C2H4,C2H2,CH4,NO。
有的气体在水中有肯定溶解度,但可以在水中加入某物质减少其溶解度,如:可用排饱和食盐水法采集氯气。
4. 水洗
用水洗的办法可除去某些难溶气体中的易溶杂质,如除去NO气体中的NO2杂质。
5. 辨别
可借助一些物质在水中溶解度或密度的不同进行物质辨别,如:苯、乙醇 溴乙烷三瓶未有标签的无色液体,用水辨别时浮在水上的是苯,溶在水中的是乙醇,沉于水下的是溴乙烷。
借助溶解性溶解热辨别,如:氢氧化钠、硝酸铵、氯化钠、碳酸钙,仅用水可辨别。
6. 检气密性
气体发生装置连好后,应用热胀冷缩原理,可用水检查其是不是漏气。
水在化学反应中的妙用
1.水参与的氧化还原反应
(1)水参与的氧化还原反应:水不是氧化剂又不是还原剂
①过氧化钠与水反应
②氯气与水
③水与二氧化氮反应生成硝酸和一氧化氮
(2)水参与的氧化还原反应:水做氧化剂
①活泼金属与水
②电解食盐水(放氢生碱型)
③水与铁在高温下反应生成氢气和铁的氧化物(四氧化三铁)
④水与碳在高温下反应生成水煤气。
⑤铝与强碱溶液反应
⑥硅与强碱溶液反应
(3)水参与的氧化还原反应:水做还原剂
①氟气与水
②电解硫酸铜(放氧生酸型)
(4)水参与的氧化还原反应:水既是氧化剂又是还原剂
水电解
2.水参与的非氧化还原反应
(1)水合
水与二氧化硫、三氧化硫、二氧化碳、五氧化二磷等酸性氧化物化合成酸。
水与氧化钠、氧化钙等碱性氧化物化合成碱。
氨的水合
无水硫酸铜水合(变色,可检验液态有机物中是不是含水)
(喀斯特地貌的形成 ,氨碱法制纯碱等与上述CO2水合,NH3水合有关;浓硫酸吸水,用硝酸镁吸水浓缩稀硝酸等也与有关物质的水合有关;工业酒精用生石灰吸水以制无水酒精)
(2)水化:
乙烯水化成乙醇
乙炔水化制乙醛
(3)水解反应:
乙酸乙酯水解
油脂水解(酸性水解或皂化反应)
水与电石反应制乙炔
四氯化钛水解
碳酸氢根的水解
(4)电离平衡:
碳酸氢根的电离
名字中带水的物质
1.与氢的同位素或氧的价态有关的水。
蒸馏水H2O 重水D2O 超重水T2O 双氧水H2O2
2.水溶液
氨水(含分子:NH3、H2O、NH3?H2O 含离子:NH4+、OH―、H+)
氯水(含分子:Cl2、H2O、HClO 含离子:H+、Cl―、ClO―、OH―)
卤水常指海水晒盐后的母液或粗盐潮解所得溶液,含NaCl、MgCl2、NaBr等
王水浓硝酸和浓盐酸的混合物(1:3)
硬水含有校多Ca2+,Mg2+的水
软水不含或只含少量Ca2+、Mg2+的水
生理盐水0.9%的NaCl溶液
水玻璃Na2SiO3溶液
3.其它
水银Hg
水晶SiO2
水泥2CaO?SiO2、 3CaO?SiO2、 3CaO?Al2O3
铁水一般指熔融的生铁,含Fe、C、Mn、Si、P等
水煤气CO 、H2的混合气
水合氢离子(H3O+)